Nykyään alkoholiton rasvamaksa (NAFLD) on noussut kroonisen maksasairauden pääasialliseksi aiheuttajaksi Kiinassa ja jopa koko maailmassa. Tautikirjoon kuuluvat yksinkertainen maksan steatohepatiitti, alkoholiton steatohepatiitti (NASH) ja niihin liittyvä kirroosi ja maksasyöpä. NASH:lle on ominaista liiallinen rasvan kertyminen maksasoluihin ja indusoitu soluvaurio ja tulehdus, johon voi liittyä maksafibroosia. Maksafibroosin vaikeusaste NASH-potilailla liittyy läheisesti huonoon maksan ennusteeseen (kirroosi ja sen komplikaatiot sekä maksasolukarsinooma), sydän- ja verisuonitapahtumiin, ekstrahepaattisiin pahanlaatuisiin kasvaimiin ja kokonaiskuolemaan. NASH voi vaikuttaa haitallisesti potilaiden elämänlaatuun, mutta NASH:n hoitoon ei ole hyväksytty lääkkeitä tai hoitoja.
New England Journal of Medicine (NEJM) -lehdessä julkaistussa tuoreessa tutkimuksessa (ENLIVEN) osoitettiin, että pegozafermiini paransi sekä maksafibroosia että maksatulehdusta biopsialla varmistettuilla ei-kirroottisilla NASH-potilailla.
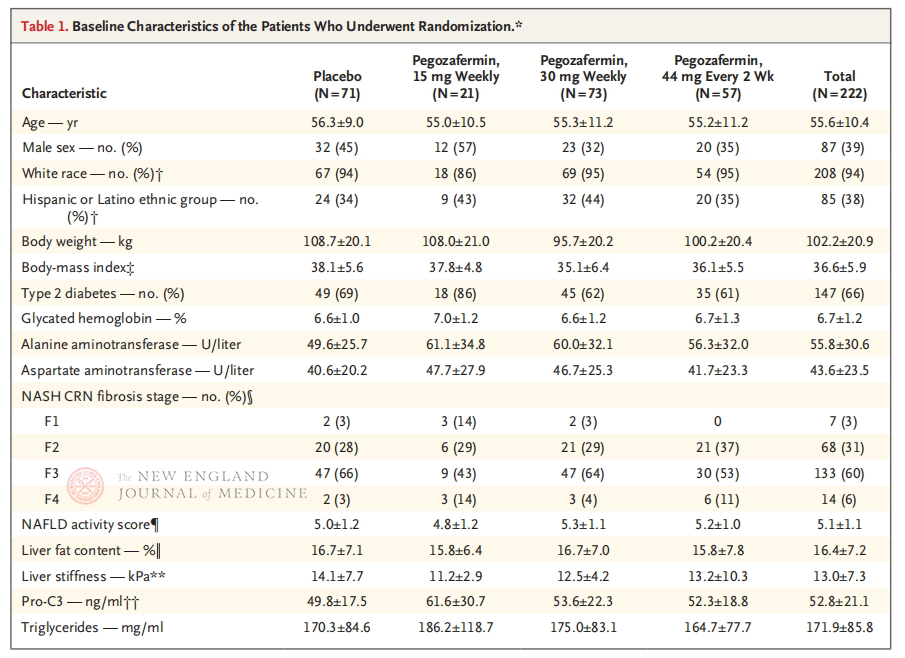
Professori Rohit Loomba ja hänen kliininen tiiminsä Kalifornian yliopiston San Diegon lääketieteellisessä tiedekunnassa suorittivat monikeskustutkimuksen, satunnaistetun, kaksoissokkoutetun ja lumekontrolloidun faasi 2b:n kliinisen tutkimuksen. Tutkimukseen osallistui 222 potilasta, joilla oli biopsialla vahvistettu vaiheen F2-3 NASH 28. syyskuuta 2021 ja 15. elokuuta 2022 välisenä aikana. Potilaat satunnaistettiin saamaan pegozafermiinia (ihonalainen injektio, 15 mg tai 30 mg kerran viikossa tai 44 mg kerran kahdessa viikossa) tai lumelääkettä (kerran viikossa tai kerran kahdessa viikossa). Ensisijaisia päätetapahtumia olivat ≥ vaiheen 1 fibroosin paraneminen ja NASH:n etenemisen puuttuminen. NASH parani ilman fibroottista etenemistä. Tutkimuksessa tehtiin myös turvallisuusarviointi.
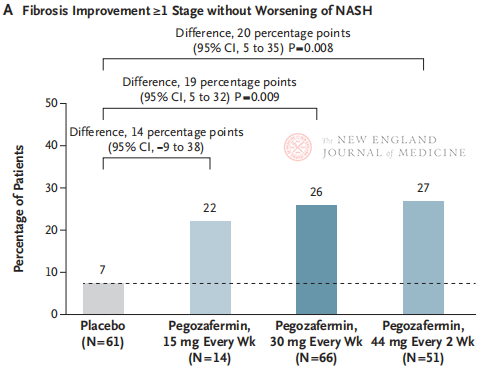
24 hoitoviikon jälkeen niiden potilaiden osuus, joilla fibroosi parani ≥ vaiheen 1 tasolle eikä NASH pahentunut, sekä niiden potilaiden osuus, joilla NASH taantui eikä fibroosi pahentunut, olivat merkitsevästi suurempia Pegozafermiini-annosryhmässä kuin lumelääkeryhmässä. Merkittävämpiä eroja havaittiin potilailla, joita hoidettiin 44 mg:lla kahden viikon välein tai 30 mg:lla kerran viikossa. Turvallisuuden osalta pegozafermiini oli samanlainen kuin lumelääke. Yleisimmät pegozafermiinihoitoon liittyvät haittavaikutukset olivat pahoinvointi, ripuli ja pistoskohdan punoitus. Tässä faasi 2b -tutkimuksessa alustavat tulokset viittaavat siihen, että pegozafermiinihoito parantaa maksafibroosia.
Tässä tutkimuksessa käytetty pegozafermiini on ihmisen fibroblastikasvutekijä 21:n (FGF21) pitkävaikutteinen glykoloitu analogi. FGF21 on maksan erittämä endogeeninen metabolinen hormoni, jolla on rooli lipidi- ja glukoosiaineenvaihdunnan säätelyssä. Aiemmat tutkimukset ovat osoittaneet, että FGF21:llä on terapeuttisia vaikutuksia NASH-potilaisiin lisäämällä maksan insuliiniherkkyyttä, stimuloimalla rasvahappojen hapettumista ja estämällä lipogeneesiä. Luonnollisen FGF21:n lyhyt puoliintumisaika (noin 2 tuntia) kuitenkin rajoittaa sen käyttöä NASH:n kliinisessä hoidossa. Pegozafermiini hyödyntää glykosyloitua pegylaatioteknologiaa luonnollisen FGF21:n puoliintumisajan pidentämiseksi ja sen biologisen aktiivisuuden optimoimiseksi.
Tämän faasi 2b -kliinisen tutkimuksen positiivisten tulosten lisäksi toinen Nature Medicine -lehdessä (ENTRIGUE) äskettäin julkaistu tutkimus osoitti, että pegozafermiini alensi merkittävästi myös triglyseridejä, ei-HDL-kolesterolia, apolipoproteiini B:tä ja maksan steatoosia vaikeaa hypertriglyseridemiaa sairastavilla potilailla, millä voi olla positiivinen vaikutus sydän- ja verisuonitapahtumien riskin vähentämiseen NASH-potilailla.
Nämä tutkimukset viittaavat siihen, että pegozafermiini voi endogeenisenä metabolisena hormonina tarjota useita metabolisia hyötyjä NASH-potilaille, erityisesti koska NASH voidaan tulevaisuudessa nimetä uudelleen metaboliaan liittyväksi rasvamaksasairaudeksi. Nämä tulokset tekevät siitä erittäin tärkeän potentiaalisen lääkkeen NASH:n hoitoon. Samalla nämä positiiviset tutkimustulokset tukevat pegozafermiinin pääsyä vaiheen 3 kliinisiin tutkimuksiin.
Vaikka sekä joka toinen viikko annettava 44 mg:n annoksina että viikoittain annettava 30 mg:n pegozafermiinihoito saavuttivat tutkimuksen histologisen ensisijaisen päätetapahtuman, hoidon kesto oli tässä tutkimuksessa vain 24 viikkoa ja lumelääkeryhmän hoitomyöntyvyyden aste vain 7 %, mikä oli merkittävästi alhaisempi kuin aiempien 48 viikkoa kestäneiden kliinisten tutkimusten tulokset. Ovatko erot ja turvallisuus samat? NASH:n heterogeenisyyden vuoksi tulevaisuudessa tarvitaan suurempia, monikeskustutkimuksia, joissa otetaan mukaan suurempia potilaspopulaatioita ja pidennetään hoidon kestoa lääkkeen tehon ja turvallisuuden arvioimiseksi paremmin.
Julkaisun aika: 16.9.2023