Epilepsiaa sairastaville lisääntymisikäisille naisille kouristuslääkkeiden turvallisuus on kriittistä sekä heille että heidän jälkeläisilleen, sillä lääkitystä tarvitaan usein raskauden ja imetyksen aikana kohtausten vaikutusten vähentämiseksi. On huolenaihe, vaikuttaako äidin epilepsialääkitys raskauden aikana sikiön elinten kehitykseen. Aiemmat tutkimukset ovat viitanneet siihen, että perinteisistä kouristuslääkkeistä valproiinihappo, fenobarbitaali ja karbamatsepiini voivat aiheuttaa teratogeenisia riskejä. Uusista kouristuslääkkeistä lamotrigiinia pidetään suhteellisen turvallisena sikiölle, kun taas topiramaatti saattaa lisätä sikiön huuli- ja suulakihalkioiden riskiä.
Useat neurologista kehitystä koskevat tutkimukset ovat osoittaneet yhteyden äidin raskaudenaikaisen valproiinihapon käytön ja jälkeläisten kognitiivisten toimintojen heikkenemisen, autismin ja tarkkaavaisuus- ja ylivilkkaushäiriön (ADHD) välillä. Korkealaatuista näyttöä äidin raskaudenaikaisen topiramaatin käytön ja jälkeläisten neurologisen kehityksen välisestä yhteydestä on kuitenkin edelleen riittämättömästi. Onneksi viime viikolla New England Journal of Medicine -lehdessä (NEJM) julkaistu uusi tutkimus tuo meille entistä enemmän näyttöä.
Todellisessa maailmassa epilepsiaa sairastavilla raskaana olevilla naisilla, jotka tarvitsevat epilepsialääkkeitä, ei ole mahdollista tehdä laajoja satunnaistettuja kontrolloituja tutkimuksia lääkkeiden turvallisuuden tutkimiseksi. Tämän seurauksena raskausrekistereistä, kohorttitutkimuksista ja tapaus-verrokkitutkimuksista on tullut yleisemmin käytettyjä tutkimusasetelmia. Metodologisesta näkökulmasta tämä tutkimus on yksi korkealaatuisimmista tutkimuksista, joita voidaan tällä hetkellä toteuttaa. Sen kohokohtia ovat seuraavat: käytetään väestöpohjaista laajan otoksen kohorttitutkimusmenetelmää. Vaikka tutkimusasetelma on retrospektiivinen, tiedot tulevat kahdesta aiemmin mukana olleesta suuresta kansallisesta tietokannasta, jotka ovat peräisin Yhdysvaltain Medicaid- ja Medicare-järjestelmistä, joten tietojen luotettavuus on korkea; mediaaniseuranta-aika oli 2 vuotta, mikä käytännössä täytti autismin diagnosointiin vaadittavan ajan, ja lähes 10 % (yhteensä yli 400 000 tapausta) seurattiin yli 8 vuotta.
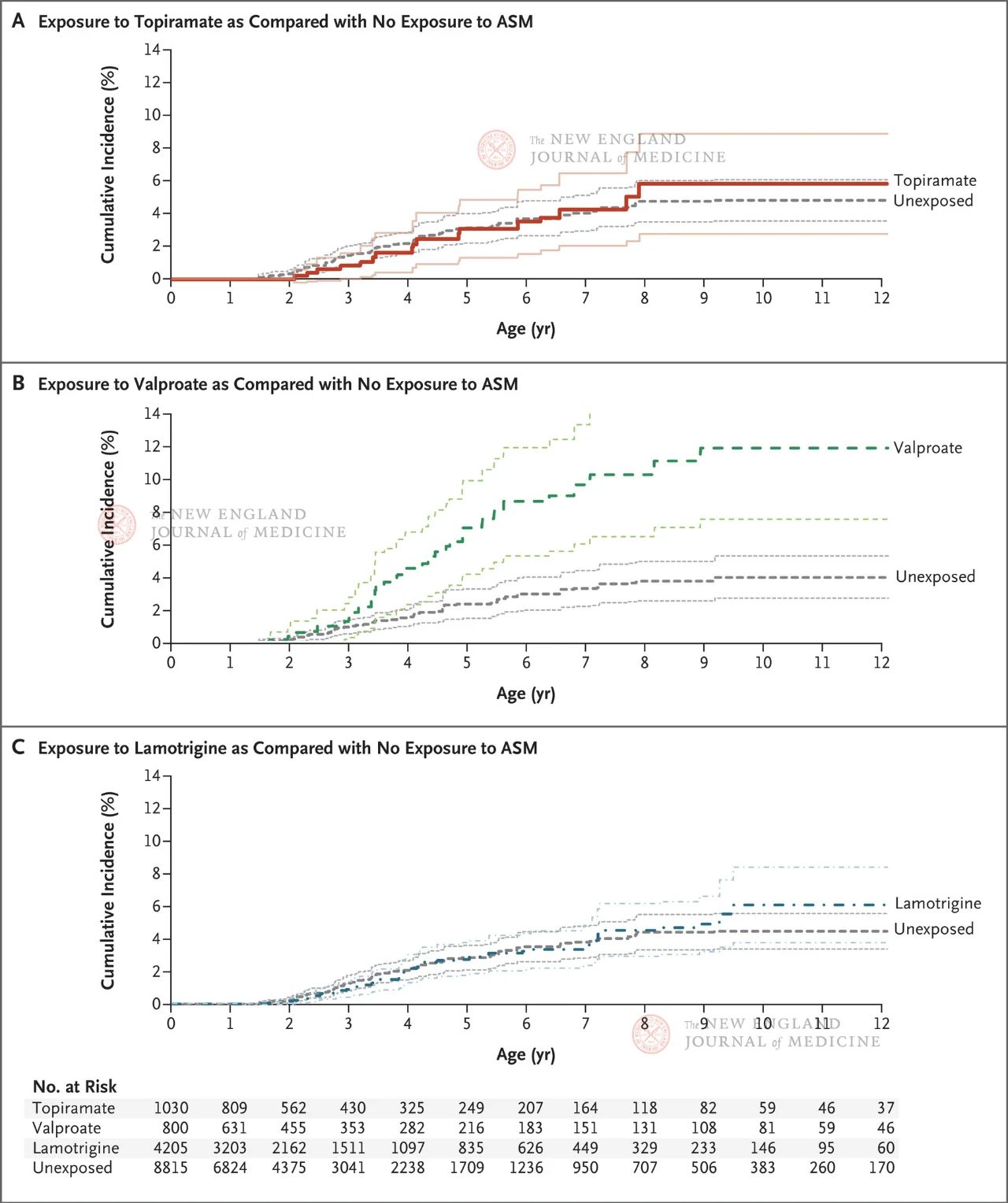
Tutkimukseen osallistui yli 4 miljoonaa tutkittavaa raskaana olevaa naista, joista 28 952:lla oli diagnosoitu epilepsia. Naiset ryhmiteltiin sen mukaan, käyttivätkö he epilepsialääkkeitä vai muita epilepsialääkkeitä 19. raskausviikon (vaihe, jossa synapsien muodostuminen jatkuu) jälkeen. Topiramaatti oli altistuneessa ryhmässä, valproiinihappo positiivisessa kontrolliryhmässä ja lamotrigiini negatiivisessa kontrolliryhmässä. Altistamattomaan kontrolliryhmään kuuluivat kaikki raskaana olevat naiset, jotka eivät käyttäneet mitään epilepsialääkkeitä 90 päivää ennen viimeisiä kuukautisiaan synnytykseen asti (mukaan lukien inaktiivinen tai hoitamaton epilepsia).
Tulokset osoittivat, että autismin arvioitu kumulatiivinen ilmaantuvuus 8-vuotiaana oli 1,89 % kaikilla jälkeläisillä, jotka eivät olleet altistuneet epilepsialääkkeille; Epileptisille äideille syntyneillä jälkeläisillä autismin kumulatiivinen ilmaantuvuus oli 4,21 % (95 %:n luottamusväli 3,27–5,16) lapsilla, jotka eivät olleet altistuneet epilepsialääkkeille. Topiramaatille, valproaatille tai lamotrigiinille altistuneiden jälkeläisten autismin kumulatiivinen ilmaantuvuus oli vastaavasti 6,15 % (95 %:n luottamusväli 2,98–9,13), 10,51 % (95 %:n luottamusväli 6,78–14,24) ja 4,08 % (95 %:n luottamusväli 2,75–5,41).
Verrattuna sikiöihin, jotka eivät olleet altistuneet epilepsialääkkeille, taipumuspistemäärien suhteen vakioitu autismin riski oli seuraava: Se oli 0,96 (95 %:n luottamusväli 0,56–1,65) topiramaattiryhmässä, 2,67 (95 %:n luottamusväli 1,69–4,20) valproiinihapporyhmässä ja 1,00 (95 %:n luottamusväli 0,69–1,46) lamotrigiiniryhmässä. Alaryhmäanalyysissä kirjoittajat tekivät samankaltaisia johtopäätöksiä sen perusteella, saivatko potilaat monoterapiaa, lääkehoidon annoksen ja oliko raskauden alkuvaiheessa lääkealtistukseen liittyvää.
Tulokset osoittivat, että epilepsiaa sairastavien raskaana olevien naisten jälkeläisillä oli suurempi autismin riski (4,21 prosenttia). Topiramaatti tai lamotrigiini eivät kumpikaan lisänneet autismin riskiä raskauden aikana epilepsialääkkeitä käyttäneiden äitien jälkeläisillä. Kuitenkin, kun valproiinihappoa otettiin raskauden aikana, jälkeläisillä havaittiin annoksesta riippuvainen autismin riskin lisääntyminen. Vaikka tutkimus keskittyi vain epilepsialääkkeitä käyttävien raskaana olevien naisten jälkeläisten autismin ilmaantuvuuteen eikä käsitellyt muita yleisiä neurologisen kehityksen tuloksia, kuten jälkeläisten kognitiivista heikkenemistä ja ADHD:ta, se silti heijastaa topiramaatin suhteellisen heikkoa neurotoksisuutta jälkeläisillä verrattuna valproaattiin.
Topiramaattia ei yleensä pidetä natriumvalproaatin suotuisana korvikkeena raskauden aikana, koska se voi lisätä huuli- ja suulakihalkioiden sekä raskausikään nähden pienen raskauden riskiä. Lisäksi on olemassa tutkimuksia, jotka viittaavat siihen, että topiramaatti voi lisätä neurologisten kehityshäiriöiden riskiä jälkeläisillä. NEJM-tutkimus kuitenkin osoittaa, että jos otetaan huomioon vain vaikutus jälkeläisten neurologiseen kehitykseen, raskaana olevilla naisilla, jotka tarvitsevat valproaattia epilepsialääkkeisiin, on välttämätöntä lisätä neurologisten kehityshäiriöiden riskiä jälkeläisillä. Topiramaattia voidaan käyttää vaihtoehtoisena lääkkeenä. On huomattava, että Aasian ja muiden Tyynenmeren saarten asukkaiden osuus koko kohortista on hyvin pieni, vain 1 % koko kohortista, ja epilepsialääkkeiden haittavaikutuksissa voi olla rotueroja, joten sen, voidaanko tämän tutkimuksen tuloksia laajentaa suoraan aasialaisiin (mukaan lukien kiinalaisiin), on vahvistettava lisää aasialaisia koskevilla tutkimustuloksilla tulevaisuudessa.
Julkaisun aika: 30.3.2024