Sairaalainfektiosta johtuva keuhkokuume on yleisin ja vakavin sairaalainfektio, josta ventilaattoriin liittyvä keuhkokuume (VAP) on 40 %:n syynä hoitoon reagoimattomien patogeenien aiheuttama VAP on edelleen vaikea kliininen ongelma. Vuosien ajan ohjeissa on suositeltu useita toimenpiteitä (kuten kohdennettua sedaatiota, pään nostoa) VAP:n ehkäisemiseksi, mutta VAP:ia esiintyy jopa 40 %:lla henkitorven intubaatiopotilaista, mikä johtaa pidempiin sairaalahoitoihin, lisääntyneeseen antibioottien käyttöön ja kuolemaan. Ihmiset etsivät jatkuvasti tehokkaampia ehkäiseviä toimenpiteitä.
Ventilaattoriin liittyvä keuhkokuume (VAP) on uusi keuhkokuumeen muoto, joka kehittyy 48 tuntia trakeaalisen intubaation jälkeen ja on yleisin ja tappavin sairaalainfektio tehohoitoyksikössä. Vuoden 2016 American Society of Infectious Diseases -suosituksissa VAP on erotettu sairaalassa hankitun keuhkokuumeen (HAP) määritelmästä (HAP viittaa vain keuhkokuumeeseen, joka ilmenee sairaalahoidon jälkeen ilman trakeaalista putkea eikä liity mekaaniseen ventilaatioon; VAP on keuhkokuume trakeaalisen intubaation ja mekaanisen ventilaation jälkeen), ja Euroopan yhdistys ja Kiina uskovat, että VAP on edelleen erityinen HAP-tyyppi [1-3].
Mekaanista ventilaatiota saavilla potilailla VAP:n ilmaantuvuus vaihtelee 9 prosentista 27 prosenttiin, kuolleisuuden arvioidaan olevan 13 prosenttia, ja se voi johtaa lisääntyneeseen systeemisten antibioottien käyttöön, pitkittyneeseen mekaaniseen ventilaatioon, pitkittyneeseen tehohoitoon ja lisääntyneisiin kustannuksiin [4-6]. HAP/VAP ei-immuunipuutteisilla potilailla johtuu yleensä bakteeri-infektiosta, ja yleisten patogeenien jakauma ja niiden resistenssiominaisuudet vaihtelevat alueen, sairaalaluokan, potilaspopulaation ja antibioottialtistuksen mukaan ja muuttuvat ajan myötä. Pseudomonas aeruginosa hallitsi VAP:hen liittyviä patogeenejä Euroopassa ja Amerikassa, kun taas Kiinan tertiaarisemmissa sairaaloissa eristettiin enemmän Acinetobacter baumanniita. Kolmasosasta puoleen kaikista VAP:iin liittyvistä kuolemista johtuu suoraan infektiosta, ja Pseudomonas aeruginosan ja Acinetobacterin aiheuttamien tapausten kuolleisuus on korkeampi [7,8].
VAP:n voimakkaan heterogeenisyyden vuoksi sen kliinisten ilmentymien, kuvantamisen ja laboratoriokokeiden diagnostinen spesifisyys on alhainen ja erotusdiagnostiikan laajuus on laaja, mikä vaikeuttaa VAP:n diagnosointia ajoissa. Samaan aikaan bakteerien resistenssi on vakava haaste VAP:n hoidolle. VAP:n kehittymisriskin arvioidaan olevan 3 %/vrk mekaanisen ventilaation ensimmäisten viiden päivän aikana, 2 %/vrk 5–10 päivän ajan ja 1 %/vrk muina aikoina. Huippuilmaantuvuus havaitaan yleensä 7 päivän ventilaation jälkeen, joten infektio voidaan ehkäistä varhaisessa vaiheessa tietyn ajanjakson kuluessa [9,10]. Monissa tutkimuksissa on tarkasteltu VAP:n ehkäisyä, mutta vuosikymmenten tutkimuksesta ja VAP:n ehkäisyyn tähtäävistä yrityksistä huolimatta (kuten intubaation välttäminen, uudelleenintubaation estäminen, sedaation vähentäminen, sängynpäädyn nostaminen 30–45° ja suunhoito) ilmaantuvuus ei näytä vähentyneen ja siihen liittyvä lääketieteellinen taakka on edelleen erittäin korkea.
Inhaloitavia antibiootteja on käytetty kroonisten hengitystieinfektioiden hoitoon 1940-luvulta lähtien. Koska se voi maksimoida lääkkeiden kulkeutumisen infektion kohdekohtaan (eli hengitysteihin) ja vähentää systeemisiä sivuvaikutuksia, se on osoittanut hyvää käyttöarvoa useissa sairauksissa. Yhdysvaltain elintarvike- ja lääkevirasto (FDA) ja Euroopan lääkevirasto (EMA) ovat nyt hyväksyneet inhaloitavat antibiootit käytettäväksi kystisen fibroosin hoidossa. Inhaloitavat antibiootit voivat merkittävästi vähentää bakteerikuormaa ja bronkiektasiapahenemisvaiheiden esiintymistiheyttä lisäämättä kokonaishaittatapahtumia, ja nykyiset ohjeet ovat tunnustaneet ne ensilinjan hoitona potilaille, joilla on pseudomonas aeruginosa -infektio ja toistuvia pahenemisvaiheita. Inhaloitavia antibiootteja keuhkonsiirron perioperatiivisena aikana voidaan käyttää myös adjuvanttina tai profylaktisena lääkkeenä [11,12]. Mutta vuoden 2016 Yhdysvaltain VAP-ohjeissa asiantuntijat eivät luottaneet adjuvanttina käytettävien inhaloitavien antibioottien tehokkuuteen, koska laajoja satunnaistettuja kontrolloituja tutkimuksia ei ollut tehty. Vuonna 2020 julkaistussa vaiheen 3 tutkimuksessa (INHALE) ei myöskään saatu positiivisia tuloksia (amikasiinilla avustettuja laskimonsisäisiä antibiootteja VAP-potilaiden aiheuttaman gramnegatiivisen bakteeritulehduksen hoitoon, kaksoissokkoutettu, satunnaistettu, lumekontrolloitu, vaiheen 3 tehokkuustutkimus, yhteensä 807 potilasta, systeeminen lääkitys + amikasiinin avustettu inhalaatio 10 päivän ajan).
Tässä yhteydessä Ranskan Toursin alueellisen yliopistollisen sairaalan (CHRU) tutkijoiden johtama ryhmä omaksui erilaisen tutkimusstrategian ja toteutti tutkijalähtöisen, monikeskustutkimuksen, kaksoissokkoutetun, satunnaistetun ja kontrolloidun tehokkuustutkimuksen (AMIKINHAL). Inhaloitavaa amikasiinia tai lumelääkettä verrattiin 19 tehohoitopotilaalla Ranskassa [13].
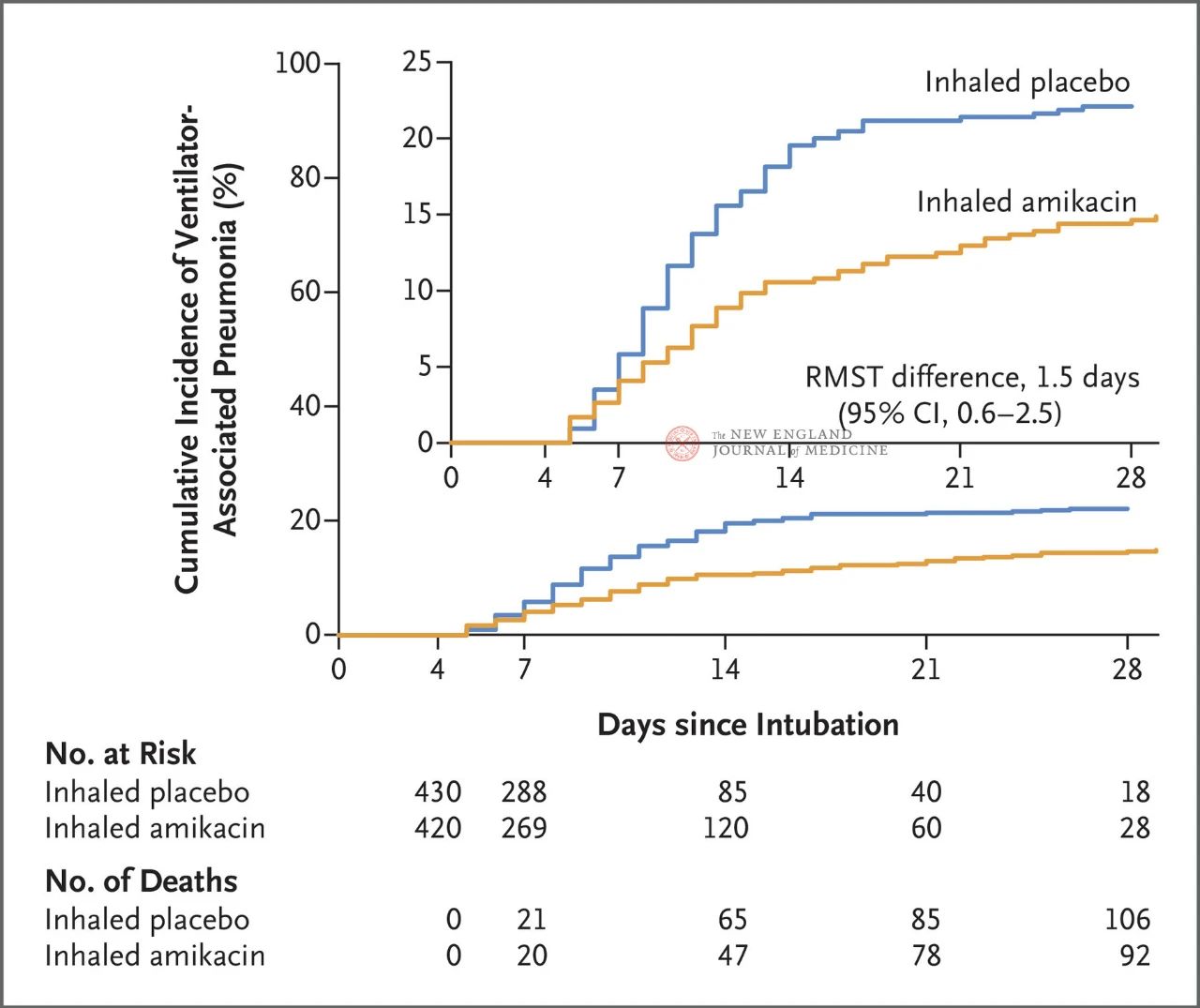
Yhteensä 847 aikuispotilasta, joille annettiin invasiivista mekaanista ventilaatiota 72–96 tunnin ajan, satunnaistettiin suhteessa 1:1 saamaan amikasiinia inhalaatiohoitona (N = 417,20 mg/kg ihannepainoa, kerran vuorokaudessa) tai lumelääkettä inhalaatiohoitona (N = 430, 0,9 % natriumkloridia vastaava määrä) kolmen päivän ajan. Ensisijainen päätetapahtuma oli ensimmäinen ventilaatioventilaatioepisodi satunnaistetun jaon alusta päivään 28.
Tutkimuksen tulokset osoittivat, että 28 päivän kohdalla 62 potilaalla (15 %) amikasiiniryhmässä oli kehittynyt VAP ja 95 potilaalla (22 %) lumelääkeryhmässä VAP (keskimääräinen eloonjäämisajan ero VAP:n osalta oli rajallinen 1,5 päivää; 95 %:n luottamusväli 0,6–2,5; P = 0,004).
Turvallisuuden osalta seitsemällä (1,7 %) amikasiiniryhmän potilaalla ja neljällä (0,9 %) lumelääkeryhmän potilaalla ilmeni tutkimukseen liittyviä vakavia haittatapahtumia. Niistä, joilla ei ollut akuuttia munuaisvauriota satunnaistamishetkellä, 11 potilaalla (4 %) amikasiiniryhmässä ja 24 potilaalla (8 %) lumelääkeryhmässä oli akuutti munuaisvaurio päivänä 28 (HR 0,47; 95 %:n luottamusväli 0,23–0,96).
Kliinisessä tutkimuksessa oli kolme kohokohtaa. Ensinnäkin tutkimusasetelman osalta AMIKINHAL-tutkimus hyödyntää IASIS-tutkimusta (satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, rinnakkainen faasi 2 -tutkimus, johon osallistui 143 potilasta). Amikasiini-fosfomysiini-inhalaatiohoidon turvallisuuden ja tehokkuuden arvioimiseksi gramnegatiivisten bakteerien aiheuttaman VAP:n aiheuttaman infektion systeemisessä hoidossa) ja INHALE-tutkimusta, joissa keskityttiin VAP:n ehkäisyyn, saatiin suhteellisen hyviä tuloksia, koska amikasiini-inhalaatiolla voidaan saavuttaa merkittävästi erilaisia tuloksia näiden potilaiden kuolleisuuden ja sairaalahoidon vähentämisessä, mikä on arvokkaampaa kliinisessä käytännössä. Kunkin potilaan ja keskuksen myöhäisen hoidon ja tuen heterogeenisyyden vuoksi tutkimusta voi kuitenkin häiritä useita sekoittavia tekijöitä, joten inhaloitavien antibioottien aiheuttaman positiivisen tuloksen saaminen voi olla vaikeaa. Siksi onnistunut kliininen tutkimus edellyttää paitsi erinomaista tutkimusasetelmaa myös sopivien ensisijaisten päätetapahtumien valintaa.
Toiseksi, vaikka aminoglykosidiantibiootteja ei suositella yksittäiseksi lääkkeeksi useissa VAP-ohjeissa, aminoglykosidiantibiootit voivat kattaa yleisiä taudinaiheuttajia VAP-potilailla (mukaan lukien pseudomonas aeruginosa, acinetobacter jne.), ja niiden rajoitetun imeytymisen keuhkojen epiteelisoluihin, korkean pitoisuuden infektiokohdassa ja alhaisen systeemisen toksisuuden vuoksi. Aminoglykosidiantibiootteja suositaan laajalti inhaloitavien antibioottien joukossa. Tämä artikkeli on yhdenmukainen aiemmin julkaistun kattavan arvion kanssa gentamisiinin intratrakeaalisen annon vaikutuksesta pienissä otoksissa, mikä yhdessä osoittaa inhaloitavien aminoglykosidiantibioottien vaikutuksen VAP:n ehkäisyssä. On myös huomattava, että useimmat inhaloitaviin antibiootteihin liittyviin tutkimuksiin valitut lumekontrolleista olivat fysiologista keittosuolaliuosta. Ottaen kuitenkin huomioon, että fysiologisen keittosuolaliuoksen inhalaatio itsessään voi olla tietty rooli ysköksen ohentamisessa ja ysköksiä irrottavassa vaikutuksessa, fysiologinen keittosuolaliuos voi aiheuttaa tiettyjä häiriöitä tutkimustulosten analysoinnissa, mikä tulisi ottaa tutkimuksessa kattavasti huomioon.
Lisäksi HAP/VAP-lääkityksen paikallinen mukauttaminen on tärkeää, samoin kuin antibioottiprofylaksia. Samalla, intubaatioajan pituudesta riippumatta, paikallisen tehohoidon ekologia on tärkein riskitekijä moniresistenttien bakteerien aiheuttamalle infektiolle. Siksi empiirisen hoidon tulisi viitata mahdollisimman paljon paikallisten sairaaloiden mikrobiologisiin tietoihin, eikä sokeasti voida viitata ohjeisiin tai kolmannen asteen sairaaloiden kokemuksiin. Samaan aikaan kriittisesti sairailla potilailla, jotka tarvitsevat mekaanista ventilaatiota, on usein yhdistelmäsairauksia, ja useiden tekijöiden, kuten stressitilan, yhteisvaikutuksessa voi esiintyä myös suolistomikrobien siirtymistä keuhkoihin. Sisäisen ja ulkoisen superposition aiheuttamien sairauksien suuri heterogeenisuus määrää myös sen, että jokaisen uuden intervention laajamittainen kliininen edistäminen on vielä pitkä matka.
Julkaisun aika: 02.12.2023